Xuất khẩu thiết bị y tế cần gì? Hồ sơ, chứng nhận và checklist tuân thủ để vào EU/US
Xuất khẩu thiết bị y tế không chỉ là làm invoice–packing list rồi gửi hàng. Đây là nhóm sản phẩm được quản lý theo mức độ rủi ro, nên để vào thị trường quốc tế (đặc biệt EU/US) bạn gần như luôn phải chuẩn bị song song: phân loại thiết bị, hệ thống quản lý chất lượng, hồ sơ kỹ thuật + thử nghiệm, nhãn/UDI + truy xuất, và bộ chứng từ thương mại.
Bài viết này tổng hợp theo dạng checklist thực chiến: “xuất khẩu thiết bị y tế cần gì” theo từng bước, đồng thời gợi ý cách triển khai để tránh các lỗi khiến hồ sơ bị trả về hoặc lô hàng bị giữ.
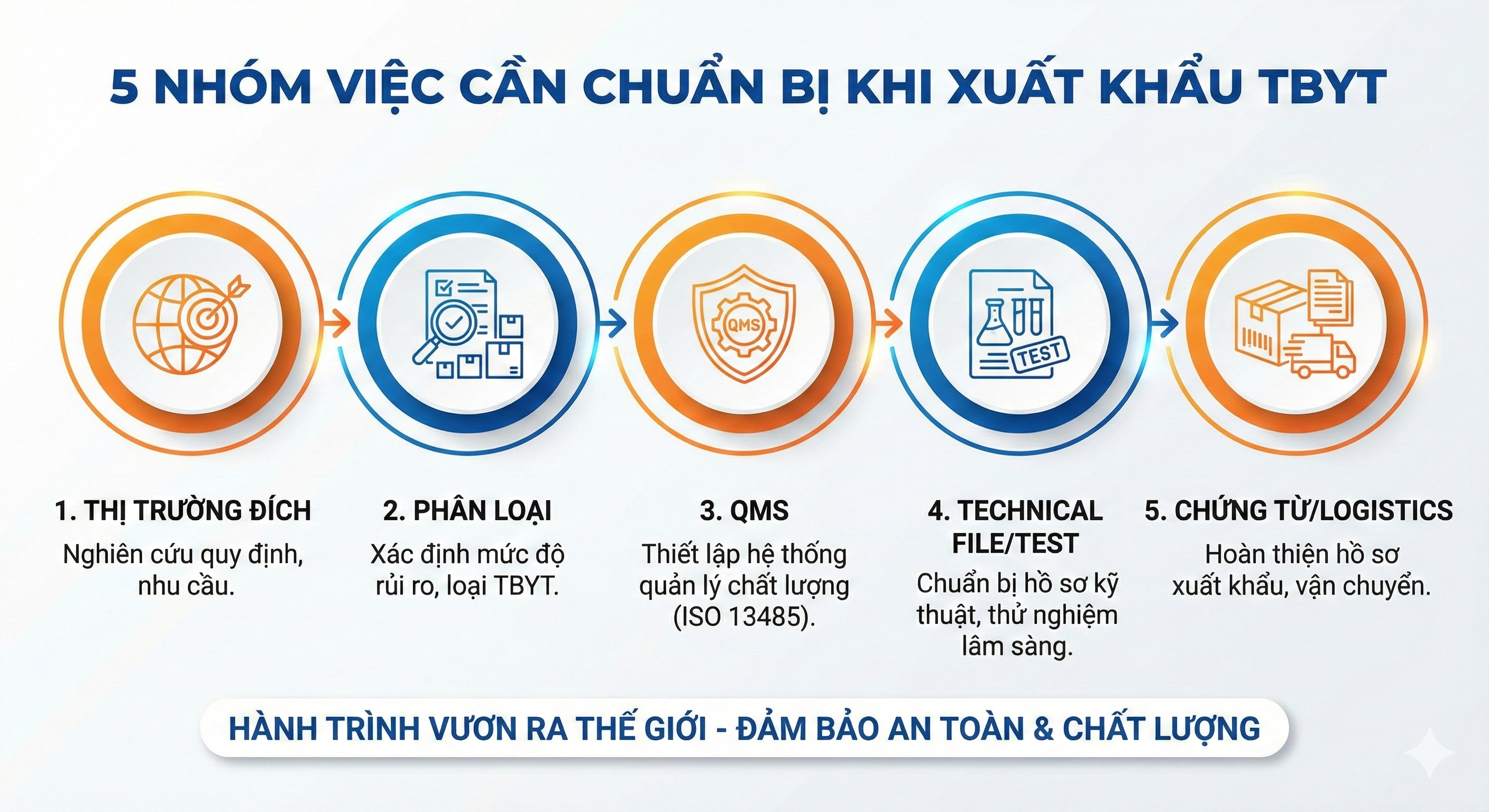
Tổng quan: Xuất khẩu thiết bị y tế cần chuẩn bị 5 nhóm việc
1) Chọn thị trường đích & mô hình bán hàng
-
Bạn xuất sang EU, Mỹ, hay thị trường khác?
-
Bạn bán B2B qua distributor, OEM, hay bán lẻ B2C?
-
Ai là “legal manufacturer”, ai chịu trách nhiệm hồ sơ/nhãn tại thị trường đích?
Chỉ cần đổi mô hình (ví dụ OEM → own brand) là yêu cầu hồ sơ có thể khác hẳn.
2) Phân loại thiết bị (quyết định mức yêu cầu)
Phân loại là “nút gốc”: càng rủi ro cao → càng nhiều yêu cầu (thử nghiệm, lâm sàng, đánh giá bên thứ ba, hậu mãi).
3) QMS & quản trị rủi ro
Thị trường lớn thường kỳ vọng doanh nghiệp có hệ thống quản lý chất lượng ngành thiết bị y tế (không chỉ ISO 9001).
4) Hồ sơ kỹ thuật – thử nghiệm – nhãn/UDI – đăng ký (tùy thị trường)
-
EU: MDR/CE + technical documentation + UDI/EUDAMED (tùy phạm vi)
-
US: cơ chế thị trường theo thiết bị (510(k)/De Novo/PMA…) + nhãn và yêu cầu liên quan
5) Chứng từ thương mại – logistics – thanh toán – bảo hiểm
Đây là phần “xuất nhập khẩu truyền thống”, nhưng với thiết bị y tế thường phải kèm tài liệu tuân thủ theo yêu cầu nhà nhập khẩu.
Bước 1: Xác định sản phẩm có phải “thiết bị y tế” không?
Điểm quyết định thường nằm ở mục đích sử dụng (intended use) và cách bạn “claim” trên nhãn/marketing. Chỉ cần claim mang tính chẩn đoán/điều trị/phòng ngừa… thì khả năng cao bị xếp vào nhóm thiết bị y tế (tùy thị trường).
Checklist thông tin nền phải chốt trước khi làm hồ sơ:
-
Intended use, đối tượng sử dụng (bệnh nhân/người dùng), môi trường dùng (bệnh viện/ở nhà)
-
Có vô trùng không? dùng 1 lần hay tái sử dụng?
-
Vật liệu có tiếp xúc cơ thể? tiếp xúc bao lâu?
-
Có điện/ pin/ RF/ phần mềm điều khiển không?
-
Cấu hình/variant/model, phụ kiện đi kèm, bộ kit
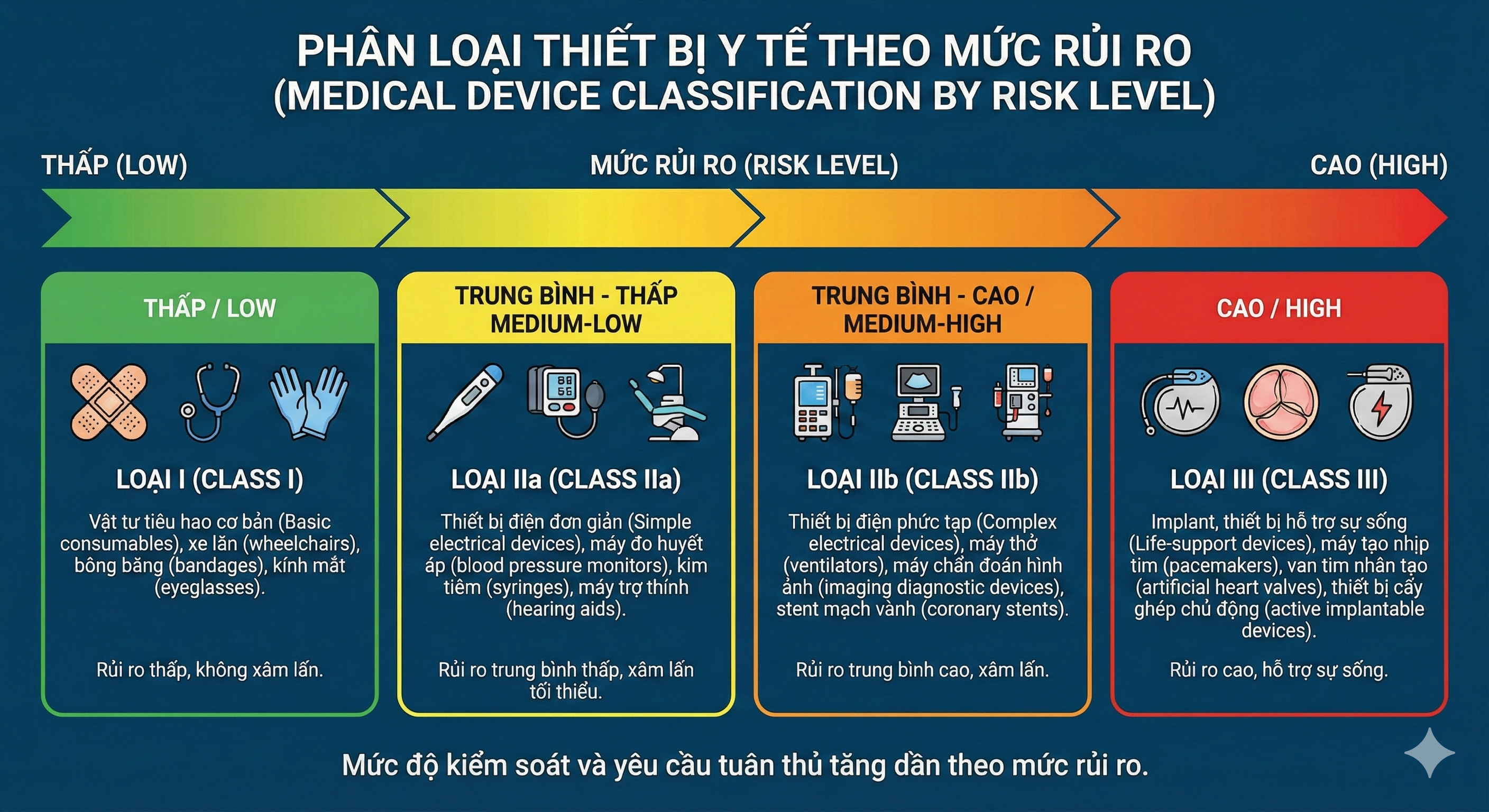
Bước 2: Phân loại thiết bị y tế – vì sao quyết định thời gian và chi phí
EU: phân loại theo MDR
Quy định nền là Regulation (EU) 2017/745 (EU MDR).
MDR phân loại theo mức rủi ro (thường gặp: Class I, IIa, IIb, III) và quy tắc phân loại nằm trong phụ lục (Annex) của MDR.
Hệ quả thực tế:
-
Class càng cao → lộ trình đánh giá phù hợp phức tạp hơn, thường cần bên đánh giá độc lập (Notified Body) và yêu cầu hậu mãi chặt hơn.
Mỹ: phân loại gắn với pathway thị trường
Ở Mỹ, thiết bị y tế thường đi theo cơ chế:
-
510(k): chứng minh “substantially equivalent” với thiết bị đã được phép lưu hành.
-
De Novo: pathway phân loại cho thiết bị “mới” (không có predicate), theo hướng rủi ro thấp–trung bình.
-
PMA: quy trình đánh giá khoa học & pháp lý cho thiết bị Class III.
Sai lầm phổ biến: nhìn “thiết bị tương tự” trên thị trường rồi tự áp class/pathway, nhưng lại quên intended use và cấu hình khác nhau → phân loại lệch, làm hồ sơ sai hướng.
Bước 3: Nền tảng gần như “mặc định” khi xuất khẩu – QMS theo ISO 13485
ISO 13485:2016 là tiêu chuẩn hệ thống quản lý chất lượng cho thiết kế và sản xuất thiết bị y tế, nhằm giúp tổ chức đáp ứng yêu cầu khách hàng và quy định về an toàn/hiệu lực.
Bộ khung QMS tối thiểu nên có (triển khai thực chiến)
-
Quản lý tài liệu & hồ sơ (document/record control)
-
Kiểm soát thiết kế (design control) – nếu bạn là nhà sản xuất
-
Quản lý nhà cung cấp (supplier control) & kiểm soát đầu vào
-
Kiểm soát sản xuất, kiểm tra/kiểm nghiệm, hồ sơ lô
-
CAPA, kiểm soát thay đổi (change control)
-
Khiếu nại, cảnh giác (vigilance), truy xuất & thu hồi (recall)
Gợi ý SEO (chèn box): “Không có ISO 13485 có xuất được không?”
-
Về pháp lý: tùy thị trường và vai trò của bạn trong chuỗi cung ứng.
-
Về thực tế: nhiều nhà nhập khẩu/đối tác yêu cầu ISO 13485 như điều kiện hợp tác (vì nó “đỡ rủi ro” cho họ).
Bước 4: Hồ sơ kỹ thuật (Technical Documentation/Technical File) cần những gì?
Bạn có thể hình dung hồ sơ kỹ thuật là “bộ chứng minh” rằng thiết bị:
-
đúng mục đích sử dụng,
-
được thiết kế/ sản xuất có kiểm soát,
-
đạt yêu cầu an toàn/hiệu năng,
-
có nhãn/IFU phù hợp,
-
và có kế hoạch hậu mãi.
Khung thành phần thường có trong Technical File
-
Mô tả thiết bị, intended use, cấu hình/variant/model
-
Yêu cầu thiết kế + bằng chứng đáp ứng (traceability)
-
Risk management file
-
Báo cáo thử nghiệm (an toàn điện/EMC/sinh học/phần mềm… tùy loại)
-
Quy trình sản xuất & kiểm soát chất lượng (đặc biệt nếu vô trùng)
-
Nhãn, IFU, cảnh báo, điều kiện bảo quản/vận chuyển
-
Kế hoạch hậu mãi (PMS), khiếu nại/thu hồi (tùy thị trường)
Mẹo để hồ sơ “dễ qua” review: làm bảng traceability “Yêu cầu → rủi ro → thử nghiệm/verification → kết quả”.
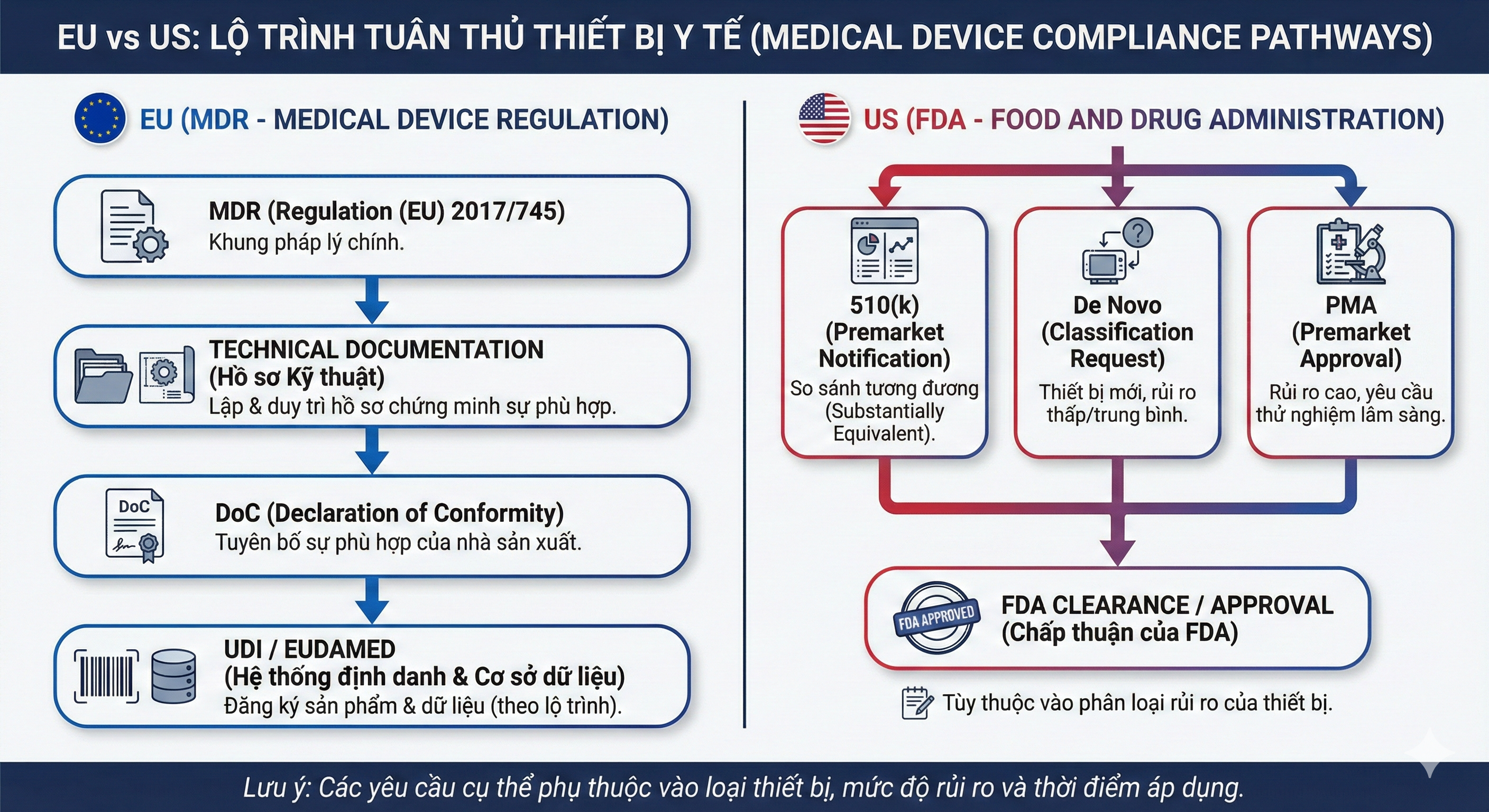
Bước 5: Vào EU cần gì? (MDR/CE + UDI/EUDAMED)
1) Khung pháp lý: EU MDR
EU quản lý thiết bị y tế theo Regulation (EU) 2017/745.
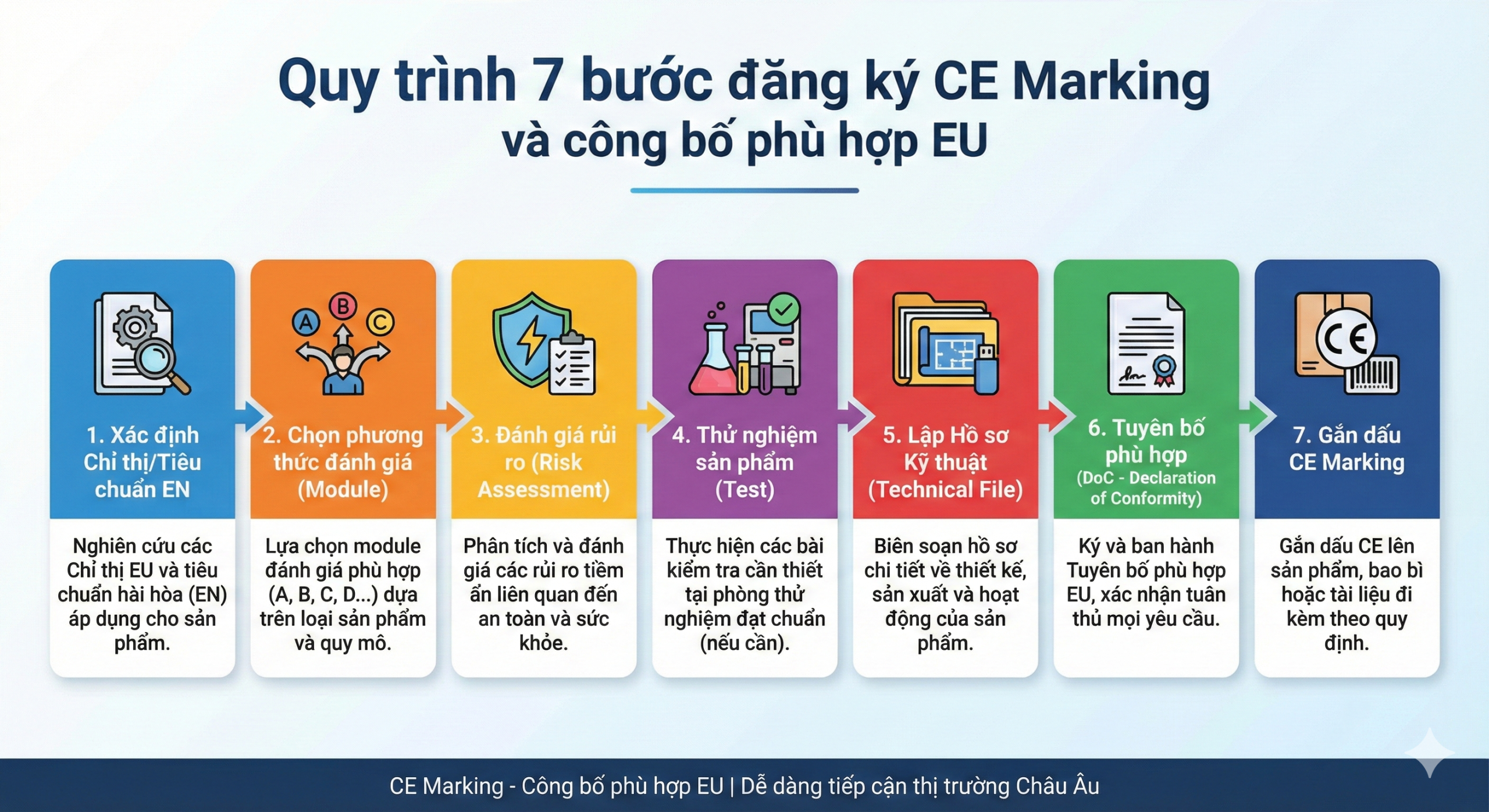
2) CE marking – khi nào cần?
Với thiết bị thuộc phạm vi MDR, việc đáp ứng MDR là cơ sở để đưa hàng ra thị trường EU (thực tế triển khai gắn với đánh giá phù hợp + hồ sơ kỹ thuật + tuyên bố phù hợp).
3) UDI & EUDAMED – vì sao liên quan xuất khẩu?
European Commission mô tả EUDAMED gồm 6 module, trong đó có module UDI & device registration.
Trang hướng dẫn của EC về UDI/Device registration cho thấy EUDAMED gắn với việc đăng ký thiết bị và dùng EMDN khi đăng ký.
Checklist EU (tổng quát, để bạn hình dung lộ trình):
-
Phân loại theo MDR + chọn route đánh giá phù hợp
-
Technical documentation theo MDR
-
EU Declaration of Conformity (DoC) và quản trị hồ sơ
-
Chuẩn bị nhãn/IFU + UDI (tùy loại) + đăng ký EUDAMED (khi áp dụng)
-
Thiết lập hậu mãi: PMS/vigilance (tùy class và yêu cầu)
Bước 6: Vào Mỹ cần gì? (FDA pathway + hồ sơ tùy thiết bị)
Ở Mỹ, “được bán” phụ thuộc vào đúng pathway của thiết bị:
-
510(k): chứng minh “substantially equivalent”.
-
De Novo: pathway cho thiết bị novel không có predicate.
-
PMA: đánh giá cho Class III.
Khi nào cần giấy tờ “export certificates” từ Mỹ?
Nếu bạn/đối tác xuất hàng từ Hoa Kỳ, U.S. Food and Drug Administration nêu CDRH phát hành 4 loại export certificates (CFG, COE theo 801(e)(1), COE theo 802, NCR) và có hướng dẫn riêng về “Types of Export Certificates”.
Lưu ý: phần export certificates này hữu ích khi chuỗi cung ứng của bạn có công đoạn/điểm xuất phát từ Mỹ (không phải mọi doanh nghiệp Việt Nam đều dùng).
Bước 7: Yêu cầu “xuyên thị trường” – nhãn, IFU, truy xuất theo lô/serial/UDI
Nhãn/IFU: đừng để “sai nhãn” làm hỏng cả lô hàng
Những điểm hay bị yêu cầu chỉnh:
-
Ngôn ngữ theo nước/khu vực
-
Cảnh báo an toàn, điều kiện bảo quản, điều kiện vận chuyển
-
Thông tin nhà sản xuất/đơn vị chịu trách nhiệm, model, lot/serial
-
Hướng dẫn sử dụng (IFU) rõ ràng, đúng intended use
Truy xuất: vì sao bắt buộc quản trị lot/serial/UDI?
Thiết bị y tế luôn gắn với:
-
xử lý khiếu nại,
-
điều tra sự cố,
-
thu hồi theo lô/serial,
-
và hậu mãi (PMS).
Nếu không quản trị theo lô/serial ngay từ đầu, bạn sẽ rất khó đáp ứng yêu cầu của nhà nhập khẩu.
REACH/RoHS có liên quan không?
Tùy sản phẩm:
-
Với “articles” bán vào EU, nếu liên quan SVHC thì có nghĩa vụ truyền thông tin trong chuỗi cung ứng theo hướng dẫn của European Chemicals Agency.
(Mình không có nguồn ECHA trong các lượt tìm kiếm ở bước này cho SVHC; nếu bạn muốn phần REACH chi tiết theo vật liệu (nhựa/silicone/cao su/dây cáp…), mình sẽ bổ sung nguồn ECHA chính thức và viết riêng một mục “hóa chất trong thiết bị”.)
Bước 8: Bộ chứng từ thương mại & logistics khi xuất khẩu thiết bị y tế
Bộ chứng từ cơ bản
-
Hợp đồng/PO
-
Commercial Invoice
-
Packing List
-
AWB/B/L
-
Chứng từ bảo hiểm (nếu có)
-
CO (nếu có/để hưởng ưu đãi)
Chứng từ “đặc thù” hay bị khách EU/US hỏi thêm
-
DoC (EU) / test reports (theo sản phẩm)
-
Chứng nhận hệ thống (ISO 13485)
-
Tài liệu kỹ thuật tóm tắt (technical summary) hoặc compliance statement
-
CFS/Free Sale (tùy thị trường nhập khẩu)
Bước 9: Xuất khẩu thiết bị y tế từ Việt Nam cần lưu ý gì?
Ở Việt Nam, quản lý trang thiết bị y tế được quy định tại Nghị định 98/2021/NĐ-CP. Cổng văn bản Chính phủ nêu thông tin ban hành và file đính kèm toàn văn.
Bản tiếng Anh cũng nêu rõ Nghị định này điều chỉnh cả xuất khẩu, nhập khẩu và các hoạt động liên quan.
Ngoài ra, nội dung công khai từ các nguồn tổng hợp pháp luật cho thấy quản lý TBYT dựa trên phân loại rủi ro và nhấn mạnh yêu cầu truy xuất nguồn gốc.
Lưu ý thực tế: tùy thị trường nhập khẩu, đối tác có thể yêu cầu thêm giấy tờ “free sale / market authorization” theo cơ chế của nước nhập. Vì vậy, đừng chỉ chuẩn bị theo “hải quan”, hãy chuẩn bị theo “compliance của thị trường đích”.
Checklist nhanh theo nhóm thiết bị (để bạn triển khai đúng hướng)
1) Thiết bị điện – điện tử (monitor, thiết bị trị liệu, máy đo…)
-
Phân loại đúng (EU/US)
-
Test plan: an toàn điện/EMC (tùy thiết bị)
-
QMS + kiểm soát nhà cung cấp linh kiện
-
Nhãn/IFU + quản trị serial/UDI (khi áp dụng)
2) Vật tư tiêu hao (kim tiêm, băng gạc, ống dẫn…)
-
Nếu vô trùng: thẩm định tiệt khuẩn/bao gói, kiểm soát môi trường sản xuất
-
Hồ sơ lô + truy xuất
-
Kiểm nghiệm vật liệu/đặc tính phù hợp mục đích sử dụng
3) Thiết bị có tiếp xúc cơ thể dài ngày/implant (nếu có)
-
Risk management mạnh
-
Bằng chứng lâm sàng/đánh giá lâm sàng (tùy thị trường)
-
Sinh học vật liệu (tùy thiết bị)
4) Phần mềm y tế (SaMD)
-
Xác định có phải thiết bị y tế không dựa trên intended use
-
Validation/verification phần mềm, quản trị phiên bản, an ninh thông tin (tùy thị trường)
Lỗi thường gặp khiến xuất khẩu thiết bị y tế bị chậm hoặc đội chi phí
-
Phân loại sai → chọn sai lộ trình chứng nhận/thử nghiệm
-
Technical file không “traceable” (yêu cầu ↔ rủi ro ↔ test ↔ kết quả không khớp)
-
Nhãn/IFU sai (thiếu cảnh báo, sai ngôn ngữ, thiếu thông tin lot/serial)
-
Không quản trị lô/serial/UDI ngay từ đầu → rủi ro khiếu nại/thu hồi
-
Làm test “rải rác”, không theo test plan → thiếu bằng chứng khi review
G-GLOBAL hỗ trợ gì khi doanh nghiệp muốn xuất khẩu thiết bị y tế?
Nếu bạn muốn triển khai theo hướng đúng ngay từ đầu (đỡ vòng lại do phân loại sai/thiếu test/thiếu hồ sơ), Công ty cổ phần tư vấn quốc tế G-GLOBAL có thể đồng hành theo lộ trình:
-
Đánh giá nhanh “market readiness” theo thị trường mục tiêu (EU/US/ASEAN…)
-
Tư vấn phân loại & lộ trình tuân thủ
-
Chuẩn hóa QMS theo ISO 13485 (quy trình + biểu mẫu + đào tạo)
-
Rà soát/hoàn thiện Technical File/Technical Documentation
-
Lập test plan phù hợp và chuẩn bị hồ sơ nhãn/IFU/UDI theo yêu cầu thị trường
-
Đồng hành audit/đánh giá và thiết lập hậu mãi (khiếu nại, PMS, truy xuất/thu hồi)
CTA mềm: Bạn chỉ cần chốt 3 thông tin: loại thiết bị – intended use – thị trường đích, là đã có thể lập checklist hồ sơ và dự trù chi phí/timeline sát hơn.
FAQ – Câu hỏi thường gặp
1) Xuất khẩu thiết bị y tế cần giấy tờ gì?
Tối thiểu có Invoice, Packing List, AWB/B/L, hợp đồng/PO. Tùy thị trường và thiết bị có thể cần DoC (EU), test report, hồ sơ kỹ thuật tóm tắt, ISO 13485, và tài liệu truy xuất lô/serial.
2) ISO 13485 có bắt buộc không?
Tùy thị trường và yêu cầu khách hàng, nhưng ISO mô tả ISO 13485 là tiêu chuẩn QMS được công nhận rộng rãi cho thiết kế/sản xuất thiết bị y tế nhằm đáp ứng yêu cầu an toàn/hiệu lực và quy định.
3) Vào EU cần gì?
Cốt lõi là tuân thủ EU MDR 2017/745 và chuẩn bị technical documentation, DoC, cùng các yêu cầu UDI/EUDAMED khi áp dụng.
4) Vào Mỹ cần gì?
Tùy thiết bị: 510(k), De Novo hoặc PMA là các pathway phổ biến; nếu xuất từ Mỹ có thể liên quan export certificates theo hướng dẫn của FDA.