Đăng ký Cơ sở Dược phẩm FDA là yêu cầu bắt buộc đối với các cơ sở sản xuất, pha chế, nhân bản, chế biến, thử nghiệm và đóng gói thuốc thành phẩm, thành phần dược phẩm hoạt động (API – Active Pharma Ingredient), bao gồm thuốc kê đơn và thuốc không kê đơn (OTC) cho mục đích phân phối thương mại tại Hoa Kỳ.
FDA quy đinh có nhiều quy định khác nhau đối với từng loại thuốc. Trong đó, các chuyên khảo không kê đơn (OTC) có các yêu cầu ít nghiêm ngặt hơn so với các loại thuốc khác.
Hiện nay, các sản phẩm thuốc không kê đơn (OTC) ngày càng đóng vai trò quan trọng trong hệ thống chăm sóc sức khỏe của Hoa Kỳ. Hiện tại có hơn 300.000 loại thuốc OTC được bán trên thị trường ở Hoa Kỳ. Để hiểu rõ hơn quy trình đăng ký và các quy định của FDA đối với các sản phẩm thuốc không kê đơn mời các bạn theo dõi các nội dung bên dưới
Đăng ký cơ sở Dược phẩm và Danh sách thuốc (OTC)
Thuốc OTC được định nghĩa là thuốc an toàn và hiệu quả để sử dụng cho cá nhân mà không cần bác sĩ kê đơn.
Các cơ sở sản xuất, bào chế, nhân bản, chế biến hoặc dán nhãn thuốc OTC dự định bán ở Hoa Kỳ phải được đăng ký với FDA, bao gồm cả việc liệt kê tất cả các loại thuốc được sản xuất hoặc sửa đổi tại các cơ sở này. Các cơ sở nước ngoài cũng phải xác định một đại lý Hoa Kỳ khi đăng ký.
Gia hạn đăng ký với FDA
Gia hạn đăng ký phải được gửi hàng năm trong khoảng thời gian từ ngày 1 tháng 10 đến ngày 31 tháng 12.
Quy trình đăng ký FDA và Danh sách thuốc (OTC)
Khách hàng có nhu cầu đăng ký FDA cho thuốc hoặc
B1: Đánh giá các thành phần hoạt động
Để đánh giá Danh sách các thành phần hoạt động, người nộp đơn phải kiểm tra xem các thành phần có thuộc danh mục được phép sử dụng cho người tiêu dùng hoặc sử dụng chăm sóc sức khỏe hay không
Thông thường các sản phẩm có thành phần hoạt động (Active Ingredients) gồm benzalkonium chloride, Alcohol (60 đến 95%) hoặc isopropyl alcohol (70 đến 91,3%), được FDA xem như sản phẩm thuốc không kê đơn (Over the counter (OTC) Drug products).
B2: Đăng ký số DUNS (Data Universal Numbering System)
Để đăng ký FDA cho thuốc không kê đơn (OTC) doanh nghiệp cần đăng ký số DUNS.
DUNS là dãy số gồm 9 chữ số có tính duy nhất, dùng để xác thực thông tin của một doanh nghiệp. Mã số này được cấp cho các doanh nghiệp bởi Tập đoàn Dun & Bradstreet (D&B), sau khi đã xác minh chắc chắn các thông tin về doanh nghiệp đó.
B3: Đánh giá tuân thủ nhãn
Việc FDA có coi một sản phẩm là thuốc hay không dựa trên mục đích sử dụng của nó. Những quy định của FDA yêu cầu phải xuất hiện trên nhãn thuốc phụ thuộc vào phân loại theo quy định của thuốc. Tất cả các loại thuốc cụ thể đều có yêu cầu ghi nhãn riêng. Cho dù một loại thuốc là thuốc bôi, tiêm hay uống đều có yêu cầu về ghi nhãn. Việc ghi nhãn không chính xác khi nhập khẩu có thể dẫn đến việc tạm giữ, cảnh báo nhập khẩu và từ chối nhập khẩu.
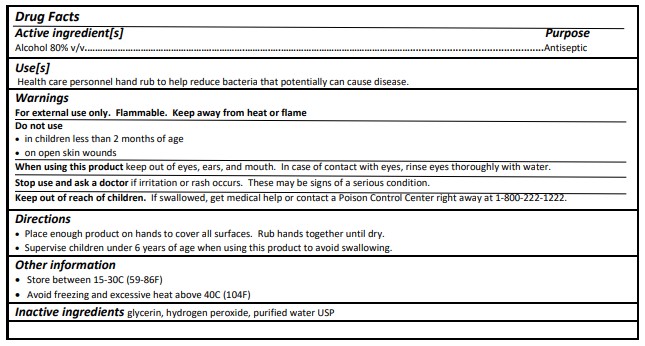
Quy định ghi nhãn cho tất cả các sản phẩm OTC được đề cập trong mục 21 CFR 201.66. FDA yêu cầu tất cả các nhãn sản phẩm thuốc OTC phải có thông tin sau đây về sản phẩm thuốc. Thông tin này phải được sắp xếp theo các tiêu đề sau và phải được trình bày theo thứ tự sau:
- Tiêu đề (Thông tin về thuốc (Drug Facts)
- (Các) thành phần hoạt tính
- Mục đích sử dụng
- Hướng dẫn sử dụng
- Các cảnh báo
- Chỉ dẫn
- Thông tin khác
- Thành phần không hoạt động.
B4: Nộp phí Cơ sở OMUFA
Vào ngày 26 tháng 3 năm 2021, Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã công bố phí sử dụng Chuyên khảo Không kê đơn (OTC) mới cho năm tài chính (FY) 2021. Bắt đầu từ năm nay, FDA sẽ yêu cầu các cơ sở bán thuốc OTC được chi trả phí cơ sở hàng năm theo Chương trình Phí người dùng chuyên khảo OTC (OMUFA).
FDA hiện sẽ yêu cầu các cơ sở sản xuất hoặc chế biến dạng bào chế thành phẩm của thuốc chuyên khảo không kê đơn phải trả phí cơ sở sản xuất thuốc chuyên khảo (MDF) hàng năm. Phí MDF cho năm tài chính 2021 là $ 20.322. Các tổ chức sản xuất theo hợp đồng (CMO), là các tổ chức MDF trong đó chủ sở hữu hoặc các chi nhánh không bán thuốc thành phẩm của họ trực tiếp cho các nhà bán buôn, bán lẻ hoặc người tiêu dùng, phải trả hai phần ba phí MDF thông thường. Phí CMO cho năm tài chính 2021 là $ 13,548.
Tuy nhiên, FDA sẽ không thu phí cơ sở OMUFA đối với các công ty đăng ký lần đầu với FDA vào trong hoặc sau tuyên bố về tình trạng khẩn cấp sức khỏe cộng đồng COVID-19 (PHE – Public Health Emergency) ngày 27 tháng 1 năm 2020 chỉ để sản xuất các sản phẩm nước rửa tay OTC trong PHE.
B5: Yêu cầu mã NDC và mã Người ghi nhãn từ FDA
Mã NDC (National Drug Code) là một số gồm 10 chữ số duy nhất để nhận dạng sản phẩm, được chia thành 3 phân đoạn: 5 chữ số đầu tiên được chỉ định bởi FDA và chúng đại diện cho mã nhà ghi nhãn/cơ sở (Labeler Code), 3 chữ số tiếp theo xác định công thức thuốc được gọi là mã sản phẩm, phân đoạn cuối cùng xác định kích thước và loại gói thương mại được gọi là mã gói.
VD về mã NDC
Để có được mã NDC Labeler từ FDA, nhà sản xuất hoặc đại lý Hoa Kỳ phải gửi yêu cầu đến FDA qua Cổng thông tin điện tử của FDA (ESG – Electronic Submission Gateway).
Tài liệu yêu cầu mã người ghi nhãn NDC gồm:
- Thông tin và số DUNS của cơ sở;
- Thông tin liên lạc của người chịu trách nhiệm nhận các thông tin liên lạc của FDA liên quan đến cơ sở đó;
- Tất cả các hoạt động kinh doanh hiện hành mà cơ sở thực hiện;
- Đối với các cơ sở nước ngoài, tên và số DUNS của một đại lý Hoa Kỳ và tất cả các nhà nhập khẩu
B6: Đăng ký thành lập cơ sở với FDA
Các nhà sản xuất thuốc OTC trong nước (sản xuất tại Hoa Kỳ) phải đăng ký cơ sở của họ với FDA trong vòng 5 ngày theo lịch sau khi bắt đầu sản xuất và hoàn thành danh sách với Số NDC 10 chữ số trong vòng 3 ngày sau khi đăng ký thành lập.
Nhà sản xuất thuốc OTC nước ngoài (sản xuất ngoài Hoa Kỳ) phải hoàn thành việc đăng ký và niêm yết thuốc trước khi bắt đầu tiếp thị tại Hoa Kỳ.
Thông tin nộp hồ sơ đăng ký cơ sở thuốc OTC gồm:
- Thông tin về công ty (gồm tên, địa chỉ, số nhân viên công ty,…)
- Tên sản phẩm, mẫu nhãn sản phẩm, hình ảnh thực tế của sản phẩm
- Mục đích sử dụng sản phẩm
- Dạng bào chế sản phẩm
- Kích thước, trọng lượng sản phẩm
- Loại bao gói
- Danh sách thành phần sản phẩm (hoặc MSDS: bảng chỉ dẫn an toàn hóa chất)
- Loại hình thành lập (nhà sản xuất/ đóng gói/ dán nhãn/ phân phối)
- Mã DUNS
- National Drug Code (NDC)
- Thông tin nhà phân phối nhãn (nếu có)
B7: Liệt kê thuốc với FDA
Cơ sở đăng ký phải liệt kê từng loại thuốc mà họ sản xuất, đóng gói lại, dán nhãn lại hoặc lưu giữ để phân phối thương mại.
Thông tin danh sách:
- NDC thích hợp
- Loại gói và thông tin khối lượng tương ứng với phân đoạn mã gói của NDC
- Tên thành lập và tên độc quyền của thuốc được liệt kê;
- Tên và số lượng của từng dược chất có trong thuốc được liệt kê;
- Tên của mỗi thành phần không hoạt động, cùng với bất kỳ xác nhận nào bảo mật liên quan đến thành phần không hoạt động riêng lẻ
- Các dạng bào chế
- Ngoài ra, tài liệu tham khảo chuyên khảo OTC của thuốc, nếu có;
Giấy chứng nhận đăng ký thuốc OTC
Sau khi bạn đăng ký xong, cơ sở thuốc đã đăng ký sẽ được FDA cấp số đăng ký FDA. Trên thực tế, FDA không cấp bất kỳ giấy chứng nhận đăng ký nào, tuy nhiên, với tư cách là đại lý bên thứ ba, Đại lý Hoa Kỳ cấp giấy chứng nhận đăng ký FDA sau khi hoàn thành đăng ký FDA cho doanh nghiệp. Doanh nghiệp có thể xác minh tình trạng đăng ký của cơ sở của mình tại trang website của FDA. FDA cập nhật tình trạng đăng ký và niêm yết hai lần một tháng.

Tra thông tin cơ sở:
https://www.accessdata.fda.gov/scripts/cder/drls/default.cfm
Tra cơ sở dữ liệu NDC cho các sản phẩm:
https://www.accessdata.fda.gov/scripts/cder/ndc/index.cfm
G- GLOBAL tự hào cung cấp
- Dịch vụ đại lý Hoa Kỳ cho các công ty nước ngoài
- Đánh giá thành phần hoạt động
- Xác định lộ trình đăng ký
- Đăng ký số DUNS
- Đánh giá tuân thủ mẫu nhãn
- Đăng ký cơ sở và lấy mã nhà ghi nhãn từ FDA
- Liệt kê danh sách sản phẩm
- Hỗ trợ thanh toán phí đăng ký của FDA
Nếu có bất kỳ thắc mắc nào về đăng ký FDA cho thuốc và cơ sở Dược phẩm vui lòng liên hệ theo phương thức sau:
Địa chỉ: Tầng 7 Tòa nhà HLT Số 23 Ngõ 37/2 Dịch Vọng Cầu Giấy Hà Nội
Điện thoại: 0985.422.225
Email: gglobal@gmail.com






